|
|
马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册

x
作者:药物政策与监管科学
“一带一路”作为中国首倡、高层推动的国家战略,对我国的经济和贸易等各方面产生了深远的影响。近年来,在“一带一路”的影响下,我国与东盟国家的合作不断加大,2015 年中国 - 东盟医药产品贸易总额达到 72.66 亿美元。同作为发展中国家,人们首选用价格低廉的仿制药替代昂贵的原研药。据统计,从 2012 年到 2015 年就有 484 个专利药品到期。全球将近 600 亿美元市场份额的生物专利药到期,为仿制药的发展带来了巨大的机遇。目前我国总体仿制药市场规模达到 5 000 亿元左右,占总药品消费市场的 40%左右 。随着仿制药质量一致性评价工作正式开展,对未来中国仿制药的发展方向有深远影响。东南亚国家联盟 (Association of Southeast Asian Nations,ASEAN) 成立于 1967 年,被视为制药出口和双边贸易的“新兴市场”。据统计,东盟仿制药市场占总市场的比例由 2010 年的 8.3%增加到 2015 年的 12.8%,达到 123 亿美元,这与东盟国家完善的仿制药注册申请制度是分不开的。
本文通过对比我国和东盟仿制药注册申请通用文件和申请程序,对未来我国仿制药产业的发展及与东盟仿制药上市申请的国际间合作提出了合理
建议。
一.仿制药注册申请通用文件对比
(一)东盟仿制药申请通用文件
ASEAN为了统一各国药品质量政策方针,成
立了质量标准咨询委员会和药品生产工作小组,并提出了药品注册的共同技术要求、东盟通用技术文件(ASEAN Common Technological Dossier,ACTD)、分析和过程验证指南、稳定性研究指南、生物利用度/生物等效性指南等一系列法规标准,所以ACTD是东盟国家中药品申请上市所用的通用格式。东盟十国的所有监管机构的基础设施相对薄弱、资源有限,监管机构最大的问题在于缺乏一致性和透明度,特别体现在对文件的评估过程,所以国家监管机构与企业进行协调,构建统一的技术要求,提交统一的技术文件。ACTD是由人用药品注册技术要求国际协调会(Internationa lConference for Harmonization,ICH)通用技术文件(Common
Technical Document,CTD)转变而来的,但还存在一定的差异。ACTD也有很大的优势,首先一个档案可用于整个区域的药品注册申请,显著减少了用于编译应用程序的时间和资源,同时体现了成员国监管机构的透明度,加快了药品的审查和审批过程;其次通过共同要素的标准文件将促进与申请人之间的监督审查和沟通,同时降低工业成本;最后单次审查、单次监测提高了公众对批准药物的信任。
(二)我国仿制药申请通用文件
随着我国国际化进程的不断加大,我国药品审
评中心(CDE)参考CTD起草了我国化学仿制药药学部分的CTD格式,并于2010年正式发布了《化学药品CTD格式申报资料撰写要求》。原国家食品药品监督管理总局(CFDA)为深化化学药品新的注册方案,于2016年5月4日发布了新的化药申报资料试行要求,其中新药和仿制药的药学资料均要求用CTD格式进行撰写申报,仿制药非临床和临床部分文件撰写也引入了CTD章节设置,这就意味着CTD格式文件正式成为化药申报注册格式。我国化学药品申请文件一个最大的问题就是申报单位未真正按照过程控制和终点控制相结合的、全面系统的药品质量控制理念,进行系统而深入的研发,仅简单地将原有的申报资料按照CTD的格式重新组合
(三)我国与东盟国家仿制药申请通用文件对比
ICH指导委员会将注册资料分为5个章节,涵
盖了一个产品的研发、生产、临床等一系列过程,体现了过程控制和重点控制相结合的药学研究资料,审评人员可以通过资料看出药品研发成功的全过程。我国与东盟国家药品申请上市所用的通用文件都是由ICH CTD转变而来的,都体现了各国在向国际主流方向发展的趋势,但还是存在一定的差异(表1)。

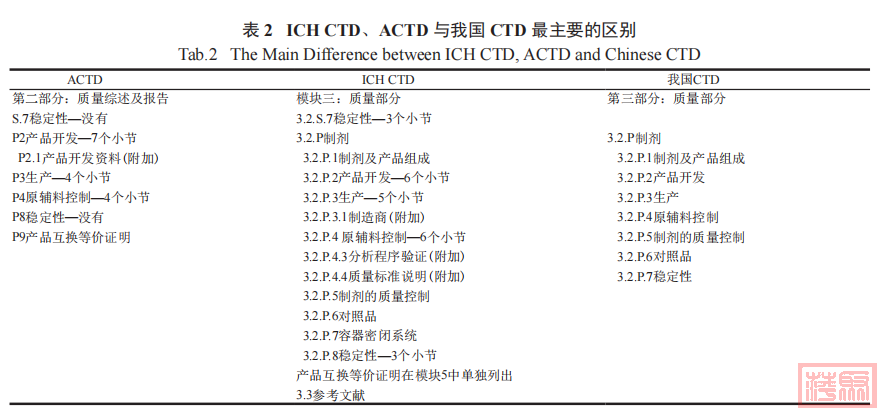
ACTD、ICH CTD 以及我国的 CTD 第一部分
都展示概述性基础信息。与 ICH CTD 相比,ACTD的综述在每个章节都有体现,并将临床或非临床的综述和研究报告合并在一个章节阐述。我国 CTD分为 4 个板块,其中药学部分相当于 ICH CTD 格式模块 2 的质量相关综述和模块 3 的质量相关文件,其中最大的区别体现在模块 2 和模块 3( 表 2)。与ICH CTD 相比,我国的 CTD 未体现文献综述一部分,而 ACTD 在质量部分没有更多体现稳定性的内容,相对而言缺乏完整性。
二.仿制药申请程序对比
(一).东盟国家仿制药申请程序
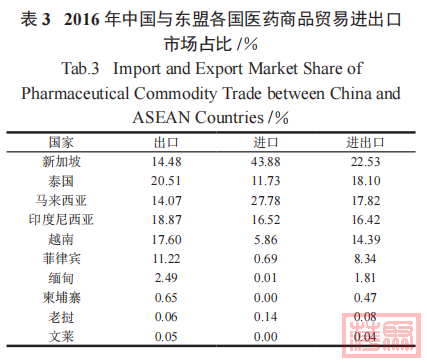
表 3 显示了 2016 年中国与东盟国家各国医药商品进出口市场中各个国家所占的比例 (数据来源:中国医药保健品进出口商会 )。由表 3 中可以看出2016 年与中国医药贸易往来所占比例较大的 3 个国家为新加坡 (22.53% )、泰国 (18.1% )、马来西亚(17.82% ),贸易总额占东盟国家贸易额的 50%以上。因此本文将详细介绍新加坡、泰国、马来西亚3 个与我国医药商品贸易往来较多国家的仿制药申请程序,并与中国仿制药申请程序进行对比。
(1)新加坡仿制药的申请程序
卫生科学局 (Health Sciences Authority,HSA)是新加坡的药品监管机构,新加坡药品注册申请分为新药申请 (NDA) 和仿制药申请 (GDA)。仿制药是指与目前在新加坡注册的药品具有相同的定性和定量方面的活性物质成分、相同的药物剂型和生物等效性的药品,若为首次规格仿制药申请则按 GDA-1 申报,反之则按 GDA-2 申报 。其中,仿制药审评需要 240 个工作日,GDA-1 的费用约3 080 美元,GDA-2 则约 1 760 美元。GDA 行政性文件包括 :综合目录、申请表、药品注册证、品牌清关有效证书复印件、标签、包装说明、患者信息单张、国外批准说明书、相关机构的评估报告、GMP 证书、批准证明、知识产权信息、GDA 验证说明。质量文件 :原料药包括原料药主文件、欧洲药典适应性证书、原料药控制、原料药稳定性数据;制剂包括产品开发、过程验证、辅料控制、制剂质量控制、容器密闭系统、制剂稳定性数据、空白生产批次记录、产品互换性。
(2)泰国仿制药申请程序
泰国药品监管机构是泰国食品药品监督管理局(Thailand Food and Drug Administration,TFDA),药品申请分为新药申请 ( 注册时需要一整套产品档案 )、仿制药申请 ( 注册时只需要产品制造与质量控制方面的档案信息 )、新型仿制药申请 ( 除了提交仿制药申请所需要的档案,还需要提交生物等效性研究资料 )。仿制药审评需要 110 个工作日,加快审评需要 70 个工作日 。仿制药申请根据申请目的,所需要的材料也有所不同。药品申请是为了进口或获得许可生产,则需要由授权持牌人亲自填写的申请表、药品配方 ( 仅限活性成分 )、药品相关文献、药品标签和包装这些材料,申请进口需要250 美元,申请生产需要 200 美元 ;若药品申请是为了获得批准认证证书则需要更多的材料,包括由授权持牌人亲自填写的申请表、药理毒理研究、临床试验、安全性和疗效研究、完整的药品配方、药品文献、生产方法、自由销售证书 ( 针对进口仿制药 ) 等材料,申请认证证书需要 65 美元。
仿制药申请需要的行政性文件包括 :申请表、品牌清关有效证书复印件、药品注册证、GMP 证书、药品生产许可证、现场主控文件、授权书、标签文件、知识产权信息、国外批准说明书。仿制药申请包括3 个步骤,首先向 TFDA 申请进口或生产样本许可,其次在医学部门申请药品质量控制和分析程序批准证书,最后在 TFDA 申请药品注册证。新型仿制药申请有以下步骤 :首先生物等效性研究必须提交药物控制部门批准,其次申请药品进口或生产样本许可证书,然后在指定的政府机构根据批准的方案进行生物等效性研究,最后提交注册申请书以及生物等效性报告和其他有用的文件。
(3)马来西亚仿制药申请程序
马来西亚药品监管机构为国家药品管理局(National Pharmaceutical Control Bureau,NPCB)。药品申请包括新药申请、仿制药申请、生物制品申请、简化审查药品申请和传统药申请。其中仿制药申请只要提供行政性资料 ( 第一部分 ) 和质量数据( 第二部分 ),对于简化申请仿制药只要提交第一部分的资料,仿制药审评需要 210 个工作日,单一活性成分仿制药申请约 670 美元 ;2 个或多个活性成分仿制药申请约 920 美元 。仿制药申请需要的行政性文件包括 :申请表、品牌清关有效证书复印件、药品注册证、GMP 证书、授权书、标签文件、知识产权信息、国外批准说明书、患者信息单张、产品信息已在哪些国家或地区批准。制剂仿制药需要辅料质量控制、成品质量控制、参考标准、包装、产品稳定性、产品互换性等质量数据,原料药仿制药需要药物生产文件,药物质量控制、稳定性、包装等质量数据。马来西亚仿制药申请首先由申请人向药物管制局提交注册申请 ( 核查 GMP 证书 ),审查员对数据进行核查,对于天然药物还要进行样本测试,然后由药物评估委员会进行核查,监管机构进行核查会议通过后发出药品生产、进口批准证书。
(二)我国与东盟国家仿制药申请程序对比
我国仿制药注册要进入药物临床研究和药品生产上市的申报与审批,一方面仿制药生物等效性(BE) 试验要获得国家药监部门的批准,另一方面在 BE 试验开展之前要开展现场检查,所以仿制药申请面临着“一报两批”的局面。此外,我国仿制药审评时间原则上为 160 天,实际审评较长 。无需临床试验类的仿制药注册费为 18.36 万元、需临床试验类的为 31.8 万元。药品审评中心在原 CTD格式的基础上,在药学研究方面又进一步细化,要求在概要中增加申请人自评估报告,确定仿制的对象是否是新法规规定的原料药、质量和疗效是否和原研药一致、资料是否科学完整 ;新增质量控制、生产信息方面的内容 ;明确起始原料和杂质谱的相关要求。2017 年 11 月,原 CFDA 研究决定自 2017年 12 月 1 日起,将由省级食品药品监督管理部门受理的药品注册申请,调整为国家食品药品监督管理总局集中受理 ( 图 1)
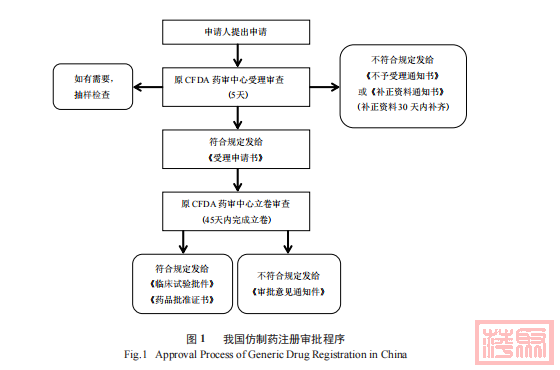
东盟国家与我国在仿制药审评时间上均提出了明确的要求,但我国实际审评时间较长,原因在于仿制药申报过程中存在严重的重复申报现象、申报质量不高、技术审评一次通过率低等一系列问题。
2015 年原 CFDA 发布的《药品、医疗器械产品注册收费标准》中将仿制药注册费用由原来的 3 000元提升到现在的 18.36 万元和 31.8 万元,目的是为提高仿制药申请注册的门槛,加快审评时间。随着我国仿制药一致性评价工作的开展,仿制药注册申请需要提交的文件发生了显著变化,增加了许多质量方面的要求,这对于保障仿制药质量及人民用药安全具有十分重要的意义。具体见表 4

引用本文
本文节选自《中国医药工业杂志》2020年第51期《“一带一路”背景下我国与东盟国家仿制药注册制度对比研究》
作者| 颜建周 赵丹 张晓宇 邵蓉
编辑| 周思源
参考文献
[1] PATEL R, PATEL A, GOHIL T.Regulatory requirement for the approval of Generic Drug in Cambodia as per ASEAN Common Technical Dossier (ACTD) [J]. Int J Drug Regul Aff, 2018, 6(2): 67-71
[2] 国家药品监督管理局药品审评中心.药审中启动CTD申报资料预审工作[EB/OL].[2011-07-07].http://wwwcde.org.cn/news.do?method=largeInfo&id=312324.
[3] 国家药品监督管理局药品审评中心. CTD 格
式申报品种审评中发现的主要问题[ EB/OL ] .[2012-12-12].
http://www.cdeorgcn/dzkwdomethod=largePage&id=312889.
[4] DIXIT P B, DILIP M.Regulatory requirement for the
approval of generic drug in Thailand as per ASEAN Common
Technical Dossier(ACTD): a review [J].J Pharm Sci
Bioscie Res, 2014, 4(4): 243-251.
[5] GOPAL P, DILIP M.A comparative study of registration
procedure for submission of generic drug in Brunei,
Darussalam and Malaysia [J].Int J Pharma Res Rev, 2014,
3(5): 52-58
[6] 宋金露.美国仿制药品注册审批制度对我国药品审批的
启示[D].郑州: 郑州大学硕士学位论文, 2016.
[7] 国家食品药品监督管理总局.总局关于调整药品注册
受理工作的公告[EB/OL].[2017-11-07].http://samr.
cfda.gov.cn/WS01/CL0087/216762.html.
受理工作的公告[EB/OL].[2017-11-07].http://samr.
cfda.gov.cn/WS01/CL0087/216762.html.
[9] LI J, ZHANG J, YANG H Y. Research on legal problems andcountermeasures of drug defect infringement-from theperspective of right relief[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2022, 39(14): 1889-1894.
[10] FDA Food and Drug Administration Report on GoodGuidance Practices, Improving Efficiency and Transparency[R]. 2011.
[11] 国家药品监督管理局. 药品管理法疫苗管理法读本[M]. 北京: 法律出版社, 2021.
[12] SONG H L, NIU J R. How is the guidance documentintroduced and further evolved?—a longitudinal study ofseven versions of the diagnosis and treatment protocol forCOVID-19[J]. J Public Adm(公共行政评论), 2020, 13(3):43-64, 194.
往期回顾
日本“患者安全用药提示”制作管理要求
对我国“患者安全用药提示相关工作的建议
医院药学服务障碍测量文献工具分析
下一篇将基于本篇提出中国-东盟制药安全监管和国际合作的建议,敬请关注!

|
|